Potasyum ferrat - Potassium ferrate - Wikipedia
 | |
 | |
| İsimler | |
|---|---|
| IUPAC adı Potasyum ferrat (VI) | |
| Diğer isimler Potasyum ferrat Dipotasyum ferrat | |
| Tanımlayıcılar | |
| Özellikleri | |
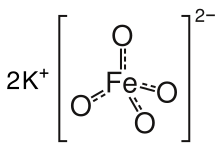
| K2FeO4 | |
| Molar kütle | 198.0392 g / mol |
| Görünüm | Koyu mor katı |
| Yoğunluk | 2.829 g / cm3, sağlam |
| Erime noktası | > 198 ° C (ayrışma sıcaklığı) |
| 1M KOH'da çözünür | |
| Çözünürlük diğer çözücülerde | çoğu çözücü ile reaksiyona girer |
| Yapısı | |
| K2YANİ4 motif | |
| Tetrahedral | |
| 0 D | |
| Tehlikeler | |
| Ana tehlikeler | Oksitleyici |
| Güvenlik Bilgi Formu | Harici SDS |
| GHS piktogramları |  [1] [1] |
| GHS Sinyal kelimesi | Tehlike[1] |
| H272[1] | |
| P210, P220, P221, P280, P370 + 378, P501[1] | |
| Alevlenme noktası | yanmaz |
| Bağıntılı bileşikler | |
Diğer anyonlar | K2MnO4 K2CrO4 K2RuO4 |
Diğer katyonlar | BaFeO4 Na2FeO4 |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |
Potasyum ferrat ... kimyasal bileşik ile formül K2FeO4. Bu mor tuz dır-dir paramanyetik ve nadir bir örnek Demir (VI) bileşik. Demir, bileşiklerinin çoğunda, paslanma durumu +2 veya +3 (Fe2+ veya Fe3+). Yüksek oksidasyon durumunu yansıtan, FeO42− güçlü oksitleyici ajan.
Sentez ve yapı

Georg Ernst Stahl (1660 - 1734) ilk olarak kalıntının bir karışımın tutuşmasıyla oluştuğunu keşfetti. potasyum nitrat (güherçile) ve Demir mor bir çözelti vermek için suda çözünen toz. Edmond Frémy (1814 - 1894) daha sonra Potasyum hidroksit ve havadaki demir (III) oksit, suda çözünür olan bir bileşik üretti:
- 4KOH + Fe2Ö3 + 3O → 2K2FeO4 + 2H2Ö
Kompozisyon şununkine karşılık geldi: potasyum manganat. Laboratuvarda, K2FeO4 bir oksitlenerek hazırlanır alkali konsantre edilmiş bir demir (III) tuzu çözeltisi klorlu ağartıcı.[2]:
- 3ClO- + 3Fe (OH)3(H2Ö)3 + 4K+ + 4OH- → 3Cl- + 2K2FeO4 + 11H2Ö
Tuz, izostrüktüreldir. K2MnO4, K2YANİ4, ve K2CrO4. Katı, K+ ve tetrahedral FeO42− anyon, Fe-O mesafesi 1.66 Å.[3] Az çözünür baryum tuzu, BaFeO4, ayrıca bilinmektedir.
Özellikler ve uygulamalar
K kullanımındaki ana zorluk2FeO4 özellikle asidik suda, suyla temas ettiğinde ayrışması gerçeğiyle gösterildiği gibi, genellikle çok reaktif olmasıdır:[4]
- 4 K2FeO4 + 4 H2O → 3 O2 + 2 Fe2Ö3 + 8 KOH
Yüksekte pH sulu çözeltiler kararlıdır. Koyu mor çözümler görünüş olarak benzerdir. potasyum permanganat (KMnO
4). İkincisinden daha güçlü oksitleyici ajandır. Kuru bir katı olarak, K2FeO4 Istikrarlı.
Redoks reaksiyonlarının yan ürünleri pas benzeri demir oksitler olduğundan, K2FeO4 "yeşil oksidan. " atık su arıtma organik kirleticiler için bir oksidan olarak ve bir biyosit. Elverişli bir şekilde, ortaya çıkan reaksiyon ürünü, mükemmel bir demir (III) oksihidroksittir. topaklaştırıcı. İçinde organik sentez, K2FeO4 oksitlenir birincil alkoller.[5] Aksine, aşağıdaki gibi ilgili oksidanlar kromat çevreye zararlı kabul edilir
K2FeO4 potansiyel olarak da dikkat çekti katot malzeme "süper demir pil."
Sulu solüsyonlardan hem çözünmüş hem de süspanse edilmiş transuranik türlerin uzaklaştırılması için stabilize edilmiş potasyum ferrat formları önerilmiştir. Belarus'taki Çernobil felaketinin etkilerinin giderilmesine yardımcı olmak için tonaj miktarları önerildi. Bu yeni teknik, çok çeşitli ağır metallerin çıkarılması için başarıyla uygulandı.[kaynak belirtilmeli ]
Transuraniklerin ve ağır metallerin potasyum ferrat çökeltilmesinin kullanılmasıyla ilgili çalışmalar, 1987 ve 1992'de ADC Laboratories ile ortaklaşa IC Technologies Inc. Laboratuvarlarında gerçekleştirildi. Transuranik türlerin uzaklaştırılması, çeşitli Bölümlerden alınan örnekler üzerinde yapıldı. ABD'deki Enerji nükleer sahalarının sayısı.[kaynak belirtilmeli ]
Yeni yaralar için kanama durdurucu olarak önerilmiştir.[6][7]
Referanslar
- ^ a b c d "Potasyum Ferrat". Amerikan Elemanları. Alındı 13 Haziran 2019.
- ^ Schreyer, J. M .; Thompson, G.W .; Ockerman, L. T. "Potassium Ferrate (VI)" Inorganic Syntheses, 1953 cilt IV, sayfalar 164-168.
- ^ Hoppe, M. L .; Schlemper, E. O .; Murmann, R.K. "Dipotasyum Ferrat (VI) Yapısı" Açta Crystallographica 1982, cilt B38, s. 2237-2239. doi:10.1107 / S0567740882008395.
- ^ Holleman, A. F .; Wiberg, E. "İnorganik Kimya" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Green, J. R. "Potasyum Ferrat" Organik Sentez için Reaktifler Ansiklopedisi 2001, John Wiley. doi:10.1002 / 047084289X.rp212.
- ^ "WoundSeal Nasıl Çalışır?". WoundSeal. 2016.
- ^ WO uygulaması 2014153566 John Hen; Talmadge Kelly Keene & Mark Travi, "Hemostatik cihaz ve yöntem", 2014-09-25 yayınlandı
