Proteaz - Protease - Wikipedia
Bir proteaz (ayrıca a peptidaz veya proteinaz) bir enzim o katalizler (oranını artırır) proteoliz dökümü proteinler küçültmek polipeptitler yada bekar amino asitler. Bunu parçalayarak yaparlar peptid bağları proteinler içinde hidroliz, suyun bağları kırdığı bir reaksiyon. Proteazlar, aşağıdakiler dahil birçok biyolojik fonksiyonda rol oynarlar: sindirim yutulan proteinlerin oranı, protein katabolizması (eski proteinlerin parçalanması),[1][2] ve telefon sinyali.
Ek yardım mekanizmaları olmadan proteoliz çok yavaş olur ve yüzlerce yıl sürer.[3] Proteazlar tüm yaşam formlarında bulunabilir ve virüsler. Bağımsız olarak var birçok kez gelişti ve farklı proteaz sınıfları aynı reaksiyonu tamamen farklı şekilde gerçekleştirebilir. katalitik mekanizmalar.
Proteazların hiyerarşisi
Katalitik kalıntıya dayalı
Proteazlar yedi geniş gruba ayrılabilir:[4]
- Serin proteazlar - serin kullanmak alkol
- Sistein proteazları - bir sistein kullanarak tiol
- Treonin proteazları - treonin kullanarak ikincil alkol
- Aspartik proteazlar - bir aspartat kullanarak karboksilik asit
- Glutamik proteazlar - bir glutamat kullanarak karboksilik asit
- Metaloproteazlar - genellikle bir metal kullanarak çinko[1][2]
- Asparagin peptid liyazları - kullanarak kuşkonmaz gerçekleştirmek için eliminasyon reaksiyonu (su gerektirmez)
Proteazlar ilk olarak 1993 yılında evrimsel ilişkilerine göre 84 aileye gruplandı ve dört katalitik tip altında sınıflandırıldı: serin, sistein, aspartik ve metalo proteazlar.[5] treonin ve glutamik asit proteazlar sırasıyla 1995 ve 2004 yılına kadar tarif edilmedi. Bir parçayı ayırmak için kullanılan mekanizma Peptit bağı yapmayı içerir amino asit olan kalıntı sistein ve treonin (proteazlar) veya bir su molekülü (aspartik asit, metalo- ve asit proteazlar) nükleofiliktir, böylece peptide saldırabilir karboksil grubu. Bir nükleofil yapmanın bir yolu, katalitik üçlü, burada bir histidin kalıntı etkinleştirmek için kullanılır serin, sistein veya treonin bir nükleofil olarak. Ancak bu, nükleofil türlerinin sahip olduğu gibi evrimsel bir gruplama değildir. yakınsak gelişti kayıtsız süper aileler ve bazı süper aileler, çok sayıda farklı nükleofile farklı evrim gösterir.
Peptit liyazları
Yedinci katalitik tipte bir proteolitik enzim olan asparagin peptid liyaz 2011'de tanımlanmıştır. Proteolitik mekanizması alışılmadık bir durumdur, çünkü hidroliz, bir gerçekleştirir eliminasyon reaksiyonu.[6] Bu reaksiyon sırasında, katalitik asparajin, doğru koşullar altında proteinlerdeki asparagin kalıntılarında kendini parçalayan döngüsel bir kimyasal yapı oluşturur. Temelde farklı mekanizması göz önüne alındığında, bir peptidaz olarak dahil edilmesi tartışmalı olabilir.[6]
Evrimsel soyoluş
Proteaz evriminin güncel bir sınıflandırması süper aileler MEROPS veritabanında bulunur.[7] Bu veri tabanında, proteazlar ilk olarak 'klan' (üst aile ) yapı, mekanizma ve katalitik kalıntı sırasına göre (örn. PA klanı burada P, nükleofil ailelerinin bir karışımını gösterir). Her bir 'klan' içinde, proteazlar şu şekilde sınıflandırılır: aileler dizi benzerliğine dayalı olarak (örneğin, PA klanındaki S1 ve C3 aileleri). Her aile, yüzlerce ilgili proteaz içerebilir (ör. tripsin, elastaz, trombin ve streptogrisin S1 ailesi içinde).
Şu anda 50'den fazla klan bilinmektedir ve her biri bağımsız bir proteoliz evrimsel kökenini göstermektedir.[7]
Optimum pH'a göre sınıflandırma
Alternatif olarak, proteazlar optimal olarak sınıflandırılabilir. pH aktif oldukları:
- Asit proteazlar
- Nötr proteazlar dahil tip 1 aşırı duyarlılık. Burada yayınladı Mast hücreleri ve aktivasyonuna neden olur Tamamlayıcı ve kininler.[8] Bu grup şunları içerir: kalpainleri.
- Temel proteazlar (veya alkali proteazlar)
Enzimatik fonksiyon ve mekanizma
Proteazlar yer alır sindirim uzun protein zincirlerini daha kısa parçalara bölerek peptid bağları o bağlantı amino asit kalıntılar. Bazıları terminal amino asitleri protein zincirinden ayırır (ekzopeptidazlar, gibi aminopeptidazlar, karboksipeptidaz A ); diğerleri bir proteinin iç peptit bağlarına saldırır (endopeptidazlar, gibi tripsin, kimotripsin, pepsin, papain, elastaz ).
Kataliz
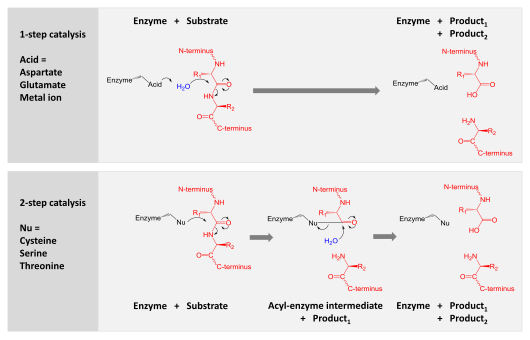
Kataliz iki mekanizmadan biriyle elde edilir:
- Aspartik, glutamik ve metaloproteazlar, hidrolize etmek için peptit bağına nükleofilik bir saldırı gerçekleştiren bir su molekülünü aktive eder.
- Serin, treonin ve sistein proteazları nükleofilik bir kalıntı kullanır (genellikle katalitik üçlü ). Bu kalıntı, nükleofilik bir saldırı gerçekleştirir. kovalent olarak proteazı substrat proteinine bağlayarak ürünün ilk yarısını serbest bırakır. Bu kovalent asil-enzim ara ürünü daha sonra, ürünün ikinci yarısını serbest bırakarak ve serbest enzimi yeniden oluşturarak katalizi tamamlamak için aktive edilmiş su ile hidrolize edilir.
Özgüllük
Proteoliz oldukça yüksek olabilir karışık öyle ki çok çeşitli protein substratları hidrolize edilir. Bu, aşağıdaki gibi sindirim enzimleri için geçerlidir. tripsin daha küçük peptid parçalarına yutulan protein dizisini parçalayabilmesi gerekir. Karışık proteazlar tipik olarak substrat üzerindeki tek bir amino aside bağlanır ve bu nedenle sadece bu kalıntı için spesifikliğe sahiptir. Örneğin, tripsin ... K ... veya ... R ... ('' = bölünme bölgesi) dizilerine özeldir.[9]
Tersine, bazı proteazlar oldukça spesifiktir ve yalnızca belirli bir diziye sahip substratları ayırır. Kan pıhtılaşması (örneğin trombin ) ve viral poliprotein işleme (örneğin TEV proteaz ), kesin bölünme olaylarının elde edilmesi için bu düzeyde özgüllük gerektirir. Bu, uzun bir bağlanma yarığına veya belirli kalıntıları bağlayan birkaç cepli tünele sahip proteazlarla sağlanır. Örneğin, TEV proteaz ... ENLYFQ S ... ('' = bölünme bölgesi) dizisine özeldir.[10]
Bozunma ve otoliz
Proteazlar, kendileri de proteinler, bazen aynı türden diğer proteaz molekülleri tarafından parçalanır. Bu, proteaz aktivitesinin düzenlenmesi için bir yöntem görevi görür. Bazı proteazlar otolizden sonra daha az aktiftir (ör. TEV proteaz ) diğerleri daha aktifken (ör. tripsinojen ).
Proteazların biyolojik çeşitliliği
Proteazlar tüm organizmalarda meydana gelir. prokaryotlar -e ökaryotlar -e virüsler. Bu enzimler, gıda proteinlerinin basit sindiriminden yüksek düzeyde düzenlenmiş kaskadlara (örn. kan pıhtılaşma kaskadı, tamamlayıcı sistem, apoptoz yollar ve omurgasız profenoloksidaz aktive edici kaskad). Proteazlar ya spesifik peptid bağlarını kırabilir (sınırlı proteoliz), bağlı olarak amino asit bir proteinin dizisini veya bir peptidi tamamen amino asitlere (sınırsız proteoliz). Aktivite, yıkıcı bir değişiklik olabilir (bir proteinin işlevini ortadan kaldırmak veya ana bileşenlerine sindirmek), bir fonksiyonun aktivasyonu olabilir veya bir sinyal yolundaki bir sinyal olabilir.
Bitkiler
Proteaz içeren bitki çözeltileri vejetaryen peynir mayası Avrupa ve orta doğuda yüzlerce yıldır kullanılmaktadır. koşer ve helal peynirler. Vejetaryen peynir mayası Withania koagülanları olarak binlerce yıldır kullanılmaktadır. Ayurveda Hint yarımadasında sindirim ve diyabet için çare. Ayrıca yapmak için kullanılır Paneer.
Bitki genomları, büyük ölçüde bilinmeyen işlevlere sahip yüzlerce proteazı kodlar. Bilinen işlevi olanlar büyük ölçüde gelişimsel düzenleme.[11] Bitki proteazları ayrıca fotosentez.[12]
Hayvanlar
Proteazlar, çeşitli metabolik süreçler için bir organizma boyunca kullanılır. Mideye salgılanan asit proteazlar (örneğin pepsin ) ve mevcut serin proteazlar duodenum (tripsin ve kimotripsin ) gıdalardaki proteini sindirmemizi sağlar. Kan serumunda bulunan proteazlar (trombin, plazmin, Hageman faktörü vb.) kanın pıhtılaşmasında, pıhtıların parçalanmasında ve bağışıklık sisteminin doğru hareketinde önemli rol oynar. Diğer proteazlar lökositlerde bulunur (elastaz, cathepsin G ) ve metabolik kontrolde birkaç farklı rol oynar. Biraz yılan zehirleri ayrıca proteazlardır, örneğin çukur engerek hemotoksin ve kurbanın kan pıhtılaşma kademesine müdahale. Proteazlar, hormonlar, antikorlar veya diğer enzimler gibi önemli fizyolojik rol oynayan diğer proteinlerin yaşam süresini belirler. Bu, bir organizmanın fizyolojisindeki en hızlı "açma" ve "kapatma" düzenleyici mekanizmalardan biridir.
Karmaşık işbirlikçi eylem ile proteazlar şu şekilde ilerleyebilir: Çağlayan Bir organizmanın fizyolojik bir sinyale tepkisinin hızlı ve verimli bir şekilde yükseltilmesine neden olan reaksiyonlar.
Bakteri
Bakteriler proteazları salgılarlar. hidroliz peptit proteinlere bağlanır ve bu nedenle proteinleri bileşenlerine ayırır amino asitler. Bakteriyel ve fungal proteazlar küresel ölçekte özellikle önemlidir karbon ve azot proteinlerin geri dönüşümündeki döngüler ve bu tür aktivite, bu organizmalardaki beslenme sinyalleri tarafından düzenlenme eğilimindedir.[13] Proteaz aktivitesinin beslenme düzenlemesinin toprakta bulunan binlerce tür arasındaki net etkisi, proteinler karbon, nitrojen veya kükürt sınırlamasına yanıt olarak parçalandıkça genel mikrobiyal topluluk düzeyinde gözlemlenebilir.[14]
Bakteriler, genel protein kalite kontrolünden sorumlu proteazlar içerir (ör. AAA + proteazom ) aşağılayarak katlanmamış veya yanlış katlanmış proteinler.
Salgılanan bir bakteriyel proteaz ayrıca bir ekzotoksin görevi görebilir ve bir hastalık oluşturma faktörü bakteri olarak patogenez (Örneğin, eksfolyatif toksin ). Bakteriyel ekzotoksik proteazlar hücre dışı yapıları tahrip eder.
Virüsler
Bazı virüslerin genomları, büyük bir poliprotein, bunu fonksiyonel birimlere ayırmak için bir proteaza ihtiyaç duyan (ör. hepatit C virüsü virüs ve pikornavirüsler ).[15] Bu proteazlar (ör. TEV proteaz ) yüksek özgüllüğe sahiptir ve yalnızca çok kısıtlı bir alt tabaka sekansı kümesini ayırır. Bu nedenle bunlar için ortak bir hedeftirler proteaz inhibitörleri.[16][17]
Kullanımlar
Proteaz araştırması alanı çok büyük. 2004 yılından bu yana her yıl bu alanla ilgili yaklaşık 8000 makale yayınlanmaktadır.[18] Proteazlar endüstride, tıpta ve temel bir biyolojik araştırma aracı olarak kullanılmaktadır.[19][20]
Sindirim proteazları pek çoğunun parçasıdır Çamaşır deterjanları ve ayrıca ekmek endüstrisinde yaygın olarak kullanılmaktadır. ekmek geliştirici. Çeşitli proteazlar tıbbi olarak hem doğal işlevleri (örneğin kanın pıhtılaşmasını kontrol etmek) hem de tamamen yapay işlevler (Örneğin. patojenik proteinlerin hedeflenen bozunması için). Gibi son derece spesifik proteazlar TEV proteaz ve trombin genellikle klivaj yapmak için kullanılır füzyon proteinleri ve yakınlık etiketleri kontrollü bir şekilde.
İnhibitörler
Proteazların aktivitesi aşağıdakiler tarafından inhibe edilir: proteaz inhibitörleri.[21] Proteaz inhibitörlerinin bir örneği, serpin üst aile. O içerir alfa 1-antitripsin (vücudu kendi aşırı etkilerinden korur iltihaplı proteazlar), alfa 1-antikimotripsin (aynı şekilde), C1 inhibitörü (vücudu kendi başına aşırı proteazla tetiklenen aktivasyondan korur tamamlayıcı sistem ), antitrombin (bu, vücudu aşırı pıhtılaşma ), plazminojen aktivatör inhibitörü-1 (proteazla tetiklenenleri bloke ederek vücudu yetersiz pıhtılaşmadan korur. fibrinoliz ), ve nöroserpin.[22]
Doğal proteaz inhibitörleri şunları içerir: lipokalin hücre düzenlenmesi ve farklılaşmasında rol oynayan proteinler. Lipofilik Lipokalin proteinlerine bağlanan ligandların tümör proteaz inhibe edici özelliklere sahip olduğu bulunmuştur. Doğal proteaz inhibitörleri ile karıştırılmamalıdır proteaz inhibitörleri antiretroviral tedavide kullanılır. Biraz virüsler, ile HIV / AIDS bunların arasında üreme döngülerindeki proteazlara bağlıdır. Böylece, proteaz inhibitörleri olarak geliştirilmiştir antiviral anlamına geliyor.
Diğer doğal proteaz inhibitörleri, savunma mekanizmaları olarak kullanılır. Yaygın örnekler şunlardır: tripsin inhibitörleri bazı bitkilerin tohumlarında bulunur, insanlar için en önemlisi, yırtıcıları caydırmak için hareket ettikleri büyük bir gıda ürünü olan soya fasulyesidir. Ham soya fasulyesi toksik insanlar dahil birçok hayvana, içerdikleri proteaz inhibitörleri denatüre olana kadar.
Ayrıca bakınız
- Proteaz
- PA klanı
- Yakınsak evrim
- Proteoliz
- Katalitik üçlü
- Proteoliz Haritası
- Anjiyogenezdeki proteazlar
- Zar içi proteazlar
- Proteaz inhibitörü (farmakoloji)
- Proteaz inhibitörü (biyoloji)
- TopFIND - proteaz özgüllüğü, substratlar, ürünler ve inhibitörler veritabanı
- MEROPS - Proteaz evrim gruplarının veritabanı
Referanslar
- ^ a b Kral John V .; Liang, Wenguang G .; Scherpelz, Kathryn P .; Schilling, Alexander B .; Meredith, Stephen C .; Tang, Wei-Jen (2014-07-08). "İnsan ön sekans proteazıyla substrat tanıma ve bozunmanın moleküler temeli". Yapısı. 22 (7): 996–1007. doi:10.1016 / j.str.2014.05.003. ISSN 1878-4186. PMC 4128088. PMID 24931469.
- ^ a b Shen, Yuequan; Joachimiak, Andrzej; Rosner, Marsha Rich; Tang, Wei-Jen (2006-10-19). "İnsan insülinini parçalayan enzimin yapıları, yeni bir substrat tanıma mekanizmasını ortaya koyuyor". Doğa. 443 (7113): 870–874. doi:10.1038 / nature05143. ISSN 1476-4687. PMC 3366509. PMID 17051221.
- ^ Radzicka A, Wolfenden R (Temmuz 1996). "Nötr Çözeltide Katalize Edilmemiş Peptit Bağ Hidrolizinin Oranları ve Proteazların Geçiş Durumu Afiniteleri". JACS. 118 (26): 6105–6109. doi:10.1021 / ja954077c.
- ^ Oda K (2012). "Yeni karboksil peptidaz aileleri: serin-karboksil peptidazlar ve glutamik peptidazlar". Biyokimya Dergisi. 151 (1): 13–25. doi:10.1093 / jb / mvr129. PMID 22016395.
- ^ Rawlings ND, Barrett AJ (Şubat 1993). "Peptidazların evrimsel aileleri". Biyokimyasal Dergi. 290 (Pt 1) (Pt 1): 205–18. doi:10.1042 / bj2900205. PMC 1132403. PMID 8439290.
- ^ a b Rawlings ND, Barrett AJ, Bateman A (Kasım 2011). "Asparagin peptit liyazları: yedinci katalitik tipte proteolitik enzimler". Biyolojik Kimya Dergisi. 286 (44): 38321–8. doi:10.1074 / jbc.M111.260026. PMC 3207474. PMID 21832066.
- ^ a b Rawlings ND, Barrett AJ, Bateman A (Ocak 2010). "MEROPS: peptidaz veritabanı". Nükleik Asitler Res. 38 (Veritabanı sorunu): D227–33. doi:10.1093 / nar / gkp971. PMC 2808883. PMID 19892822.
- ^ Mitchell RS, Kumar V, Abbas AK, Fausto N (2007). Robbins Temel Patolojisi (8. baskı). Philadelphia: Saunders. s. 122. ISBN 978-1-4160-2973-1.
- ^ Rodriguez J, Gupta N, Smith RD, Pevzner PA (Ocak 2008). "Tripsin prolinden önce keser mi?" Proteom Araştırmaları Dergisi. 7 (1): 300–5. doi:10.1021 / pr0705035. PMID 18067249.
- ^ Renicke C, Spadaccini R, Taksiler C (2013-06-24). "P1 'konumunda artmış substrat toleransına sahip bir tütün dağlama virüsü proteazı". PLOS One. 8 (6): e67915. doi:10.1371 / journal.pone.0067915. PMC 3691164. PMID 23826349.
- ^ van der Hoorn RA (2008). "Bitki proteazları: fenotiplerden moleküler mekanizmalara" (PDF). Bitki Biyolojisinin Yıllık İncelemesi. 59: 191–223. doi:10.1146 / annurev.arplant.59.032607.092835. hdl:11858 / 00-001M-0000-0012-37C7-9. PMID 18257708.
- ^ Zelisko A, Jackowski G (Ekim 2004). "Lhcb3'ün yaşlanmaya bağlı bozunmasına, tilakoid membrana bağlı proteaz aracılık eder". Bitki Fizyolojisi Dergisi. 161 (10): 1157–70. doi:10.1016 / j.jplph.2004.01.006. PMID 15535125.
- ^ Sims GK (2006). "Nitrojen Starvation, Topraktaki N-Heterosiklik Bileşiklerin Biyodegradasyonunu Teşvik Ediyor". Toprak Biyolojisi ve Biyokimyası. 38 (8): 2478–2480. doi:10.1016 / j.soilbio.2006.01.006.
- ^ Sims GK, Wander MM (2002). "Azot veya kükürt sınırlaması altında proteolitik aktivite". Appl. Toprak Ecol. 568: 1–5.
- ^ Tong L (2002). "Viral Proteazlar". Kimyasal İncelemeler. 102 (12): 4609–4626. doi:10.1021 / cr010184f. PMID 12475203.
- ^ Skoreński M, Sieńczyk M (2013). "İlaç tasarımı için hedef olarak viral proteazlar". Güncel İlaç Tasarımı. 19 (6): 1126–53. doi:10.2174/13816128130613. PMID 23016690.
- ^ Yilmaz NK, Swanstrom R, Schiffer CA (Temmuz 2016). "Viral Proteaz İnhibitörlerinin İlaç Direncine Karşı Geliştirilmesi". Mikrobiyolojideki Eğilimler. 24 (7): 547–557. doi:10.1016 / j.tim.2016.03.010. PMC 4912444. PMID 27090931.
- ^ Barrett AJ, Rawlings ND, Woessnerd JF (2004). Proteolitik enzimler el kitabı (2. baskı). Londra, İngiltere: Elsevier Academic Press. ISBN 978-0-12-079610-6.
- ^ Hooper NM, ed. (2002). Biyoloji ve tıpta proteazlar. Londra: Portland Press. ISBN 978-1-85578-147-4.
- ^ Feijoo-Siota L, Villa TG (28 Eylül 2010). "Doğal ve Biyoteknolojik Olarak Tasarlanmış Endüstriyel Bitkisel Proteazlar". Gıda ve Biyoproses Teknolojisi. 4 (6): 1066–1088. doi:10.1007 / s11947-010-0431-4.
- ^ Southan C (Temmuz 2001). "İlaç hedefleri olarak insan proteazlarına genomik bir perspektif". Bugün İlaç Keşfi. 6 (13): 681–688. doi:10.1016 / s1359-6446 (01) 01793-7. PMID 11427378.
- ^ Puente XS, López-Otín C (Nisan 2004). "Sıçan proteazlarının ve proteaz inhibitörlerinin genomik analizi". Genom Araştırması. 14 (4): 609–22. doi:10.1101 / gr.1946304. PMC 383305. PMID 15060002.
Dış bağlantılar
| Kütüphane kaynakları hakkında Proteaz |
- Uluslararası Proteoliz Derneği
- MEROPS - peptidaz veritabanı
- Proteaz inhibitörlerinin listesi
- Proteaz kesme belirleyicisi
- Proteazların listesi ve özellikleri (Ayrıca bakınız [1] )
- Proteolitik Yollar Merkezi'nden Proteoliz MAP
- Proteolysis Cut Site veritabanı - kullanıcılardan derlenmiş uzman ek açıklaması
- Proteaz kesim siteleri grafik arayüzü
- Kesilen bölgeleri, substratları ve protein uçlarını kapsayan TopFIND proteaz veritabanı
- Proteazlar ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
