Treonin amonyak-liyaz - Threonine ammonia-lyase
| L-treonin amonyak liyaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Treonin deaminaz tetramerin 3 boyutlu bir karikatür tasviri | |||||||||
| Tanımlayıcılar | |||||||||
| EC numarası | 4.3.1.19 | ||||||||
| Veritabanları | |||||||||
| IntEnz | IntEnz görünümü | ||||||||
| BRENDA | BRENDA girişi | ||||||||
| ExPASy | NiceZyme görünümü | ||||||||
| KEGG | KEGG girişi | ||||||||
| MetaCyc | metabolik yol | ||||||||
| PRIAM | profil | ||||||||
| PDB yapılar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontolojisi | AmiGO / QuickGO | ||||||||
| |||||||||
Treonin amonyak-liyaz, aynı zamanda yaygın olarak treonin deaminaz veya treonin dehidrataz, bir enzim dan sorumlu katalizör dönüşümü L-treonin içine alfa-ketobutirat ve amonyak. Alfa-ketobutirat dönüştürülebilir L-izolösin, bu nedenle treonin amonyak-liyaz, önemli bir enzim olarak işlev görür. BCAA sentez.[1] Bir piridoksal-5'-fosfat kofaktör, dahil olan birçok enzime benzer şekilde amino asit metabolizma. İçinde bulunur bakteri, Maya, ve bitkiler Ancak bugüne kadarki araştırmaların çoğu bakterilerdeki enzim formlarına odaklanmıştır. Bu enzim, içinde bulunduğu ilk enzimlerden biriydi. olumsuz geribildirim bir son ürün tarafından engellenmesi metabolik yol doğrudan gözlemlendi ve çalışıldı.[2] Enzim, amino asitte kullanılan düzenleyici stratejilerin mükemmel bir örneğidir. homeostaz.
Yapısı
Treonin amonyak-liyaz bir tetramer aynı alt birimler ve olarak düzenlenmiştir dimer dimer. Her alt birimin iki etki alanları: katalitik aktif siteyi içeren bir alan ve allosterik düzenleyici siteler. İkisinin farklı bölgeler olduğu gösterilmiştir,[3] ancak bir alt birimin düzenleyici sitesi aslında başka bir alt birimin katalitik bölgesi ile etkileşime girer.[4] Her iki alan da tekrar eden yapısal motif içerir. beta sayfaları ile çevrili alfa sarmalları.[5] Treonin bağlanma sahası tam olarak anlaşılmasa da, yapısal çalışmalar piridoksal fosfat kofaktörünün nasıl bağlandığını ortaya koymaktadır.[4] PLP kofaktörü bir lizin bir vasıtasıyla kalıntı Schiff tabanı, ve fosfat PLP grubu tarafından yerinde tutulur amin tekrar eden bir diziden türetilen gruplar glisin kalıntılar. aromatik yüzük bağlı fenilalanin ve halkadaki nitrojen hidrojen bağlı -e hidroksil grup içeren kalıntılar.[6]

Mekanizma
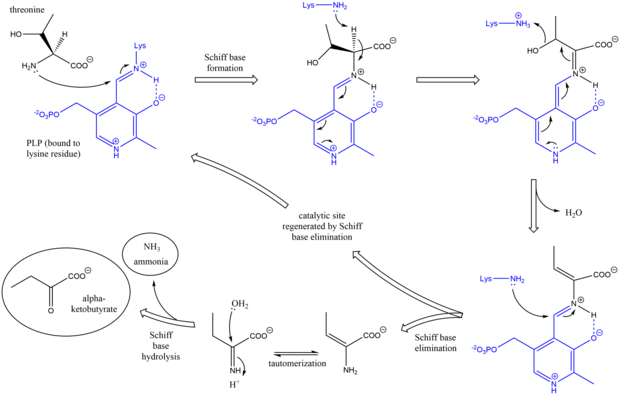
Treonin amonyak-liyaz mekanizması, Schiff bazı kullanımında diğer deaminasyon önleyici PLP enzimlerine benzerdir. ara maddeler.[7] Başlangıçta, treoninin amin grubu lizini yerinden ederek lizin / PLP Schiff bazına saldırır. Sonra protonsuzlaşma amino asidin alfa karbon Ve müteakip dehidrasyon (dolayısıyla ortak adı treonin dehidrataz), yeni bir Schiff tabanı oluşturulur. Bu Schiff bazı, katalitik olarak aktif PLP'yi yeniden biçimlendiren ve bir başlangıç alken - içeren ürün. Bu ürün totomerize eder, ve sonra hidroliz Schiff bazının nihai ürünleri üretilir.[8][9] Nihai alfa-ketobutirat ürünü oluşturulduktan sonra, izolösin, ara maddeler alfa-asetohidroksibutirat yoluyla alfa-beta-dihidroksi-beta-metilvalerata, ardından alfa-keto-beta-metilvalerata ilerleyerek sentezlenir.[10]
Yönetmelik
Treonin amonyak-liyazın takip etmediği gösterilmiştir. Michaelis-Menten kinetiği daha ziyade karmaşık allosterik kontrole tabidir.[11] Enzim engellenmiş katıldığı yolun ürünü olan izolösin tarafından ve aktive edilir valin paralel bir yolun ürünü.[1] Bu nedenle, izolösin konsantrasyonundaki bir artış, üretimini durdurur ve valin konsantrasyonundaki bir artış, başlangıç materyalini (Hidroksietil-TPP ) valin üretiminden uzak. Enzim, izolösin için iki bağlanma yerine sahiptir; biri yüksek yakınlık izolösin için ve diğeri düşük afiniteye sahiptir.[12] İzolösinin yüksek afinite sahasına bağlanması, düşük afinite sahasının bağlanma afinitesini arttırır ve enzim deaktivasyonu, izolösin düşük afinite sahasına bağlandığında meydana gelir. Valin, yüksek afinite bölgesine rekabetçi bir şekilde bağlanarak enzim aktivitesini teşvik eder ve izolösinin inhibe edici bir etkiye sahip olmasını önler.[12] Bu iki geri bildirim yönteminin kombinasyonu, BCAA'ların konsantrasyonunu dengeler.

İzoformlar ve diğer işlevler
Çoklu formlar treonin amonyak-liyazın çeşitli Türler organizmanın. İçinde Escherichia coli Enzimin kapsamlı bir şekilde çalışıldığı bir sistem, enzimin iki farklı formu bulunur. Biri biyosentetik ve burada sunulan enzim özelliklerine benzer, diğeri ise bozucu ve karbon parçaları oluşturma işlevleri enerji üretimi.[2] İzoform çifti diğer bakterilerde de gözlemlenmiştir. Çoğu bakteride, enzimin biyolojik olarak parçalanabilen izoformu şu şekilde ifade edilir: anaerobik koşullar ve terfi ediyor kamp ve treonin, biyosentetik izoform olarak ifade edilirken aerobik koşullar.[13] Bu, bakterinin enerji depolarını dengelemesine ve enerji bol olmadığında enerji tüketen sentetik yolları engellemesine izin verir.
Bitkilerde treonin amonyak-liyaz, karşı savunma mekanizmalarında önemlidir. otoburlar ve yanıt olarak yukarı düzenlenir abiyotik stres.[14] Otçulları caydıran benzersiz özelliklere sahip uyarlanmış bir enzim izoformu bitki yapraklarında ifade edilir. Bu izoformun katalitik alanı son derece dirençlidir. proteoliz düzenleyici alan kolayca bozulurken, bu nedenle başka bir organizma tarafından yutulduğunda, enzimin treonin deaminasyon yetenekleri kontrol edilmez. Bu, otobur daha onu absorbe etmeden treonini indirgeyerek, bir otçulun aç kalmasına neden olur. esansiyel amino asit.[15] Bitkilerdeki treonin amonyak-liyaz çalışmaları, aynı zamanda GDO'lar esansiyel amino asit içeriğini artırarak artan besin değeri ile.[14]
Enzimin boyut olarak son derece küçük olan, ancak yine de tüm katalitik ve düzenleyici işlevleri koruyan daha egzotik formları bulunmuştur.[4]
Evrim
PLP'ye bağımlı enzimler için beş ana katlama türü vardır. Treonin amonyak-liyaz, Fold Type II ailesinin bir üyesidir ve aynı zamanda triptofan sentaz aile.[7] Treonin amonyak-liyaz içermemesine rağmen alt tabaka tünelleme triptofan sentazının yaptığı gibi, çok fazla korunmuş homoloji. Treonin amonyak-liyaz en çok serin dehidrataz ve her ikisi de aynı genel katalitik mekanizmaya sahiptir.[9] Aslında, treonin amonyak-liyazın bir miktar özgüllük sergilediği gösterilmiştir. serin ve serini piruvat.[2] Treonin amonyak-liyazın düzenleyici alanı, düzenleyici etki alanına çok benzer. fosfogliserat dehidrojenaz.[4] Tüm bu ilişkiler treonin amonyak-liyazın birbirine yakın olduğunu göstermektedir. evrimsel bu enzimlere bağlar. Korunan dereceden dolayı yapı ve sıra amino asitleri tanıyan enzimlerde, bu enzimlerin evrimsel çeşitliliğinin, çeşitli şekillerde bireysel düzenleyici ve katalitik alanların bir araya getirilmesiyle ortaya çıkması muhtemeldir.[1]
İnsanlarla alaka
Treonin amonyak liyaz insanlarda bulunmaz. Dolayısıyla bu, insanların neden 20 tanesini de sentezleyemediğinin bir örneğidir. proteinojenik amino asitler; bu özel durumda, insanlar treonini izolösine dönüştüremez ve diyette izolösin tüketmelidir.[1] Enzim de geçmişte mümkün olduğu kadar incelenmiştir. tümör baskılayıcı ajan daha önce açıklanan nedenlerden dolayı, tümör hücrelerini önemli bir amino asitten yoksun bırakması ve onları öldürmesi,[16] ancak bu tedaviden yararlanılmadı.
Referanslar
- ^ a b c d e Berg JM, Tymoczko JL, Stryer L (2012). Biyokimya (7. baskı). New York: W.H. Freeman ve Şirketi. ISBN 978-1-4292-7635-1.
- ^ a b c Umbarger HE, Brown B (Ocak 1957). "Escherichia coli'de treonin deaminasyonu. II. İki L-treonin deaminaz için kanıt". Bakteriyoloji Dergisi. 73 (1): 105–12. doi:10.1128 / jb.73.1.105-112.1957. PMC 289754. PMID 13405870.
- ^ Changeux J (1963). "E. coli K12'den Biyosentetik L-treonin Deaminaz üzerinde Allosterik Etkileşimler". Kantitatif Biyoloji üzerine Cold Spring Harbor Sempozyumu. 28: 497–504. doi:10.1101 / SQB.1963.028.01.066.
- ^ a b c d Gallagher DT, Gilliland GL, Xiao G, Zondlo J, Fisher KE, Chinchilla D, Eisenstein E (Nisan 1998). "Piridoksal fosfata bağımlı allosterik treonin deaminazın yapısı ve kontrolü". Yapısı. 6 (4): 465–75. doi:10.1016 / s0969-2126 (98) 00048-3. PMID 9562556.
- ^ Schneider G, Käck H, Lindqvist Y (Ocak 2000). "B6 vitaminine bağımlı enzimlerin çeşitliliği". Yapısı. 8 (1): R1-6. doi:10.1016 / S0969-2126 (00) 00085-X. PMID 10673430.
- ^ a b Goto M (2005). "T.th. HB8 Treonin deaminazın Kristal Yapısı". doi:10.2210 / pdb1ve5 / pdb. Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ a b Eliot AC, Kirsch JF (2004). "Piridoksal fosfat enzimleri: mekanik, yapısal ve evrimsel hususlar". Biyokimyanın Yıllık Değerlendirmesi. 73 (1): 383–415. doi:10.1146 / annurev.biochem.73.011303.074021. PMID 15189147.
- ^ a b Umbarger HE (2009). "Treonin Deaminazlar". Meister A'da (ed.). Enzimolojideki Gelişmeler ve Moleküler Biyolojinin İlgili Alanları. Enzimolojideki Gelişmeler - ve Moleküler Biyolojinin İlgili Alanları. 37. John Wiley & Sons. sayfa 349–95. doi:10.1002 / 9780470122822.ch6. ISBN 978-0-471-59172-6. PMID 4570068.
- ^ a b c Jin J, Hanefeld U (Mart 2011). "C = C bağlarına seçici su ilavesi; enzimler en iyi kimyagerlerdir". Kimyasal İletişim. 47 (9): 2502–10. doi:10.1039 / c0cc04153j. PMID 21243161.
- ^ Squires CH, Levinthal M, De Felice M (Kasım 1981). "Escherichia coli K12'de alfa-asetolaktat biyosentezinin düzenlenmesinde treonin deaminazın rolü". Genel Mikrobiyoloji Dergisi. 127 (1): 19–25. doi:10.1099/00221287-127-1-19. PMID 7040602.
- ^ Changeux JP (1961). "L-izolösin ile biyosentetik L-treonin deaminazın geri besleme kontrol mekanizmaları". Kantitatif Biyoloji üzerine Cold Spring Harbor Sempozyumu. 26: 313–8. doi:10.1101 / SQB.1961.026.01.037. PMID 13878122.
- ^ a b Wessel PM, Graciet E, Douce R, Dumas R (Aralık 2000). "Bölgeye yönelik mutajenez, kinetik ve bağlanma deneyleri ile treonin deaminazda iki farklı efektör bağlanma bölgesi için kanıt" (PDF). Biyokimya. 39 (49): 15136–43. doi:10.1021 / bi001625c. PMID 11106492.
- ^ Luginbuhl GH, Hofler JG, Decedue CJ, Burns RO (Ekim 1974). "Salmonella typhimurium'un biyolojik olarak parçalanabilen L-treonin deaminazı". Bakteriyoloji Dergisi. 120 (1): 559–61. doi:10.1128 / jb.120.1.559-561.1974. PMC 245803. PMID 4370904.
- ^ a b Joshi V, Joung JG, Fei Z, Jander G (Ekim 2010). "Bitkilerde treonin, metiyonin ve izolösin metabolizmasının birbirine bağımlılığı: abiyotik stres altında birikim ve transkripsiyonel düzenleme". Amino asitler. 39 (4): 933–47. doi:10.1007 / s00726-010-0505-7. PMID 20186554.
- ^ Gonzales-Vigil E, Bianchetti CM, Phillips GN, Howe GA (Nisan 2011). "Böcek otçullarına karşı bitki savunmasında treonin deaminazın adaptif evrimi". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 108 (14): 5897–902. doi:10.1073 / pnas.1016157108. PMC 3078374. PMID 21436043.
- ^ Greenfield RS, Wellner D (Ağustos 1977). "Treonin deaminazın doku kültüründe memeli hücrelerinin büyümesi ve yaşayabilirliği üzerindeki etkileri ve lösemi hücrelerine karşı seçici sitotoksisitesi". Kanser araştırması. 37 (8 Pt 1): 2523–9. PMID 559542.